西湖大学团队耗时6年设计的dVGAC人工离子通道,能精准抑制神经元放电60%以上,为治疗癫痫等疾病开辟新路径。这项突破首次实现动态响应型跨膜蛋白设计,结合AI技术攻克了蛋白质设计领域长期瓶颈。
最近科学圈又搞出大动静啦!北京时间2025年10月16号,西湖大学卢培龙团队联合李波、黄晶等一众“科研大神”,在国际顶级期刊《细胞》上甩出一篇重磅论文,标题那叫一个酷炫——“De novo designed voltage-gated anion channels suppress neuron firing”,翻译成人话就是:全新设计的电压门控阴离子通道能抑制神经元放电。这消息一出来,科学界直接“炸锅”了,有媒体20号一报道,全世界都知道了西湖大学又干了件“惊天地泣鬼神”的大事。
这研究可不是一朝一夕搞成的,卢培龙团队那可是“咬定青山不放松”,整整花了6年时间才啃下这块“硬骨头”。团队里个个都是“高手”,通讯作者卢培龙是西湖大学特聘研究员,蛋白质设计领域的“扛把子”;李波是讲席教授,神经生物学团队的“带头大哥”;黄晶也是研究员,实力杠杠的。第一作者周晨、李辉灿、王佳兴这几个博士生,那也是“初生牛犊不怕虎”,跟着前辈们一路“打怪升级”。

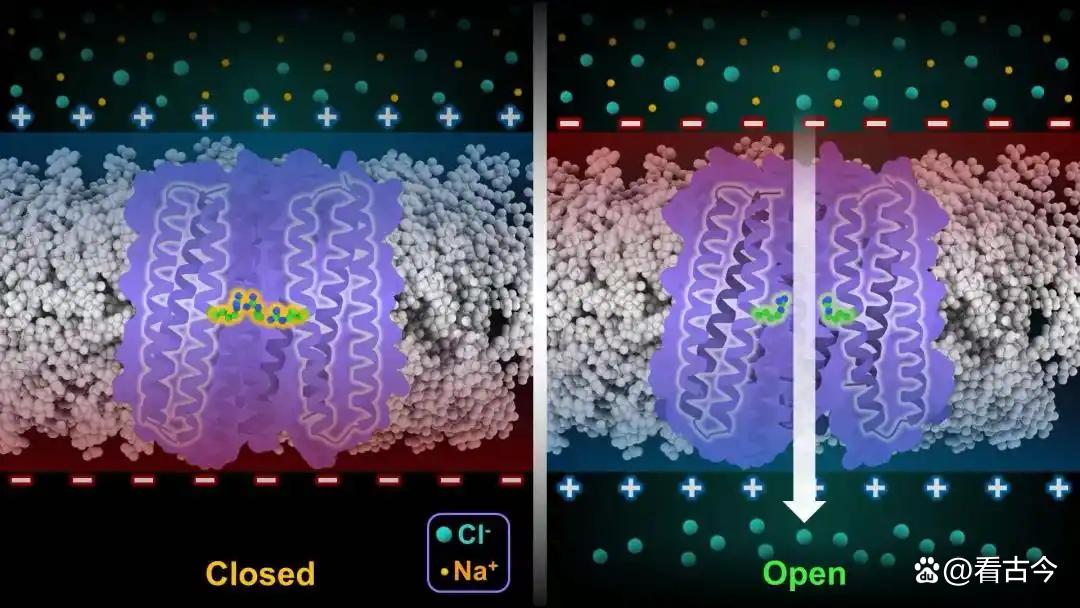
他们设计出来的人工通道叫dVGAC,这名字一听就“高大上”。这通道结构特别“牛”,是个五聚体跨膜蛋白,由15根α螺旋组成,就像个“倒漏斗”,内腔直径还能根据情况动态调整,简直就是个“智能小孔”。用冷冻电镜解析,分辨率能达到2.9 Å,跨膜区Cα原子均方根偏差(RMSD)才1.09 Å,和设计模型那叫一个“严丝合缝”,就像量身定做的衣服一样合身。

功能方面,这dVGAC更是“神通广大”。电压响应特别灵敏,膜电位超过40 mV的时候,通道就像被“激活”了一样打开,电流随着电压升高就像坐火箭一样呈指数级增长,开放概率和电压还是正相关。离子选择性也超厉害,只让阴离子(像Cl⁻、Br⁻这些)通过,阳离子(比如Na⁺)想都别想,完全被“拒之门外”,选择性顺序是Cl⁻ > Br⁻ > F⁻ > NO₃⁻ > I⁻,就像个严格的“门卫”。

为了验证这人工通道的效果,团队还拿小鼠做了实验。把dVGAC植入Prkcd-cre小鼠杏仁核中央核(CeA)神经元里,结果发现,表达dVGAC的神经元放电频率直接“跳水”,降幅超过60%,而没感染的细胞啥变化都没有。而且这人工通道在小鼠体内特别“听话”,没引发免疫反应,也没造成组织损伤,生物相容性那是杠杠的。

这研究的技术突破也特别大。以前蛋白质设计都是静态的,这次直接跨越到动态响应型跨膜蛋白,能感知电压变化还能调控构象,就像给蛋白质装了个“智能开关”。算法上也玩出了新花样,把传统蛋白质设计算法和深度学习工具AlphaFold2结合起来,优化氨基酸序列和结构稳定性,就像给蛋白质做了个“全面升级”。还在孔道里引入三层精氨酸残基,一下子就实现了电压感应和离子筛选双重功能,把天然通道的复杂结构都给“比下去了”。

这成果的科学价值更是没法说。对基础研究来说,就像打开了一扇新大门,让咱们对人工设计离子通道有了新认识,也为理解天然离子通道的进化和功能提供了新视角。从应用方面看,未来潜力无限。通过调整电压激活阈值,能开发出精准调控神经元活动的生物制剂,治疗癫痫、慢性疼痛这些病就有新希望了。还能为合成生物学工具提供通用框架,在生物传感器、细胞治疗这些领域大显身手。

国际上对这研究那是赞不绝口。《细胞》审稿人说这研究展示了从头设计功能性跨膜蛋白的巨大潜力,是人工智能驱动的生物分子设计向实际应用迈出的关键一步。国际同行也说这成果突破了蛋白质设计领域的长期瓶颈,给精准医学带来了颠覆性技术。在国内,西湖大学在蛋白质设计领域那是“一路狂飙”,连续取得突破,这次又巩固了国际领先地位,研究团队的成果还入选了“2025年度中国生命科学十大进展”候选项目,被科技部列为“十四五”生物经济重点发展方向案例,简直太牛啦!

虽然现在人工通道的生产成本、量产工艺这些数据还没公开,临床前毒理学实验进展也没披露,和制药企业的合作计划也没说,但咱有理由相信,西湖大学这帮“科研大神”肯定能继续“搞事情”,给咱们带来更多惊喜,让科学更好地造福人类!
本文来自于百家号作者:看古今,仅代表原作者个人观点。本站旨在传播优质文章,无商业用途。如不想在本站展示可联系删除