今天给各位分享算平衡常数的时候只算气体和纯液体的吗的知识,其中也会对算平衡常数时液体是不是不考虑进行解释,如果能碰巧解决你现在面临的问题,别忘了关注本站,现在开始吧!
固体和纯液体为什么不写进平衡常数
1、平衡常数中的纯液体通常指的是溶剂水,但在特定情况下需根据反应体系具体分析。首先,在化学平衡常数的计算中,固体和纯液体的浓度被视为常数,通常不代入平衡常数的表达式中进行计算。这里的“纯液体”主要指的是溶剂,最常见的就是水。
(图片来源网络,侵删)
2、能写入平衡常数表达式的状态有:气体,溶液 在气相中反应和在溶液中反应,固体和纯液体的标准浓度视为1,所以对平衡常数没有影响,故不写入平衡常数。在稀水溶液中进行的反应,水的浓度是一个常数,而且这个常数通常与平衡常数相合并,所以,也不写入平衡常数表达式。
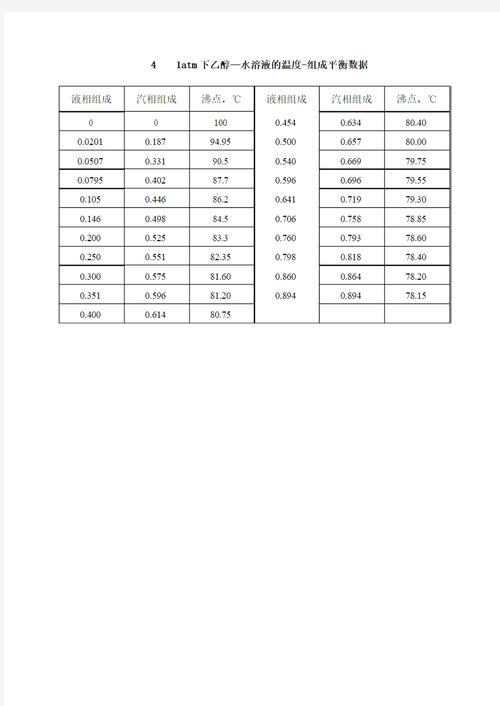
3、纯液体不写入平衡常数表达式是对水溶液而言的。但是这一反应是有机物的反应,并且乙醇、乙酸、水是互溶的,所以它们有各处的浓度。
4、平衡常数中的纯液体通常指的是溶剂水。以下是关于平衡常数中纯液体的几点详细说明:定义与范围:在化学平衡常数的计算中,纯液体主要指的是溶剂,而最常见的溶剂就是水。处理方式:在进行平衡常数计算时,固体和纯液体的浓度被视为常数,通常不代入平衡常数的表达式中进行计算。
(图片来源网络,侵删)
水的溶解平衡常数
溶解平衡常数,简称溶度积(Ksp),是描述难溶电解质在水中达到沉淀溶解平衡时的离子浓度幂之积的常数。定义 难溶电解质在水中尽管难溶,但仍会有一部分阴阳离子进入溶液,同时这些离子又会在固体表面沉积下来。当这两个过程的速率相等时,难溶电解质的溶解就达到了平衡状态,此时固体的量不再减少,这种平衡状态被称为沉淀溶解平衡。
Kw表示水的离子积常数,Kw=[H+][OH-]。常温下(298K)Kw=10的-14次方 Ka,酸反应平衡常数。其中,a作为角标,是acid(酸)的缩写。K是常数的常用写法。ksp称为溶解平衡常数;它只是温度的函数,即一定温度下ksp一定。
定义:溶解平衡常数是难溶电解质在水中达到溶解平衡时,溶液中离子浓度幂的乘积的常数。它反映了难溶电解质在水中的溶解能力。平衡状态:难溶电解质在水中会建立一种特殊的动态平衡,即一部分阴阳离子进入溶液,同时进入溶液的阴阳离子又会在固体表面沉积下来。
(图片来源网络,侵删)
溶解平衡常数,简称溶度积,是描述难溶电解质在水中达到沉淀溶解平衡时的离子浓度幂之积的常数。以下是关于溶解平衡常数的详细解释:定义:难溶电解质在水中会建立一种特殊的动态平衡,即一部分阴阳离子进入溶液,同时进入溶液的阴阳离子又会在固体表面沉积下来。
溶解平衡常数,简称溶度积,是描述难溶电解质在水中达到沉淀溶解平衡时的离子浓度幂之积的常数。以下是关于溶解平衡常数的详细解释:定义:溶度积是难溶电解质在特定温度下,达到沉淀溶解平衡时,溶液中各离子浓度的幂之积的常数。它反映了难溶电解质在水中的溶解能力。
对于水的电离常数,由于水是纯液体,没有具体的浓度概念,因此分母设定为1。水的电离常数K(水)表示为c(H+)·c(OH-)。在沉淀溶解平衡中,因为反应物为沉淀固体,同样没有浓度的概念,所以分母也为1。以Mg(OH)2为例,其溶度积常数Ksp[Mg(OH)2]可表示为c(Mg2+)·c(OH-)。
平衡常数中的纯液体是指什么啊
在化学平衡常数的表达式中,通常只包含气体和溶液中的离子浓度,而不包含纯液体、纯固体和溶剂的浓度。这一点在化学原理中是正确的,原因如下: **浓度定义**:平衡常数表达式中的浓度指的是溶液中溶质的活性粒子(分子或离子)的浓度。
综上所述,纯固体和纯液体在平衡常数计算中被忽略的原因是它们的浓度是恒定的,活度为1,相态限制了它们在反应中的自由度,以及实验观察的限制。然而,这并不意味着纯固体和纯液体在化学反应中没有作用。实际上,它们在许多化学反应中都起到了关键的作用,如提供反应平台、参与多相反应等。
不管是液体还是气体,按mol/L计算都是没有问题的。只是标准平衡常数都要将浓度项除以1mol/L而变成没有单位。严格的纯液体是不存在,但当一种液体其浓度变化很小时可以看成纯液体,因为其浓度就是一个常数。
为纯液体。代入化学平衡常数公式,1:1即为纯液体。
关于算平衡常数的时候只算气体和纯液体的吗和算平衡常数时液体是不是不考虑的介绍到此就结束了,不知道你从中找到你需要的信息了吗 ?如果你还想了解更多这方面的信息,记得收藏关注本站。
本文可能通过AI自动登载或用户投稿,文章仅代表原作者个人观点。本站旨在传播优质文章,无商业用途。如侵犯您的合法权益请联系删除。