今天给各位分享20%浓度怎么配置的知识,其中也会对20%的浓度怎么配进行解释,如果能碰巧解决你现在面临的问题,别忘了关注本站,现在开始吧!
20%盐酸溶液如何配置
1、采用浓度5%~20%的盐酸水溶液,把需要除锈的工件浸泡在盐酸溶液中一段时间即可。稀盐酸具有和铁锈反应的化学性质,可以除去生锈物件表面的铁锈。盐酸是氯化氢气体的水溶液,工业级盐酸浓度在37%。
(图片来源网络,侵删)
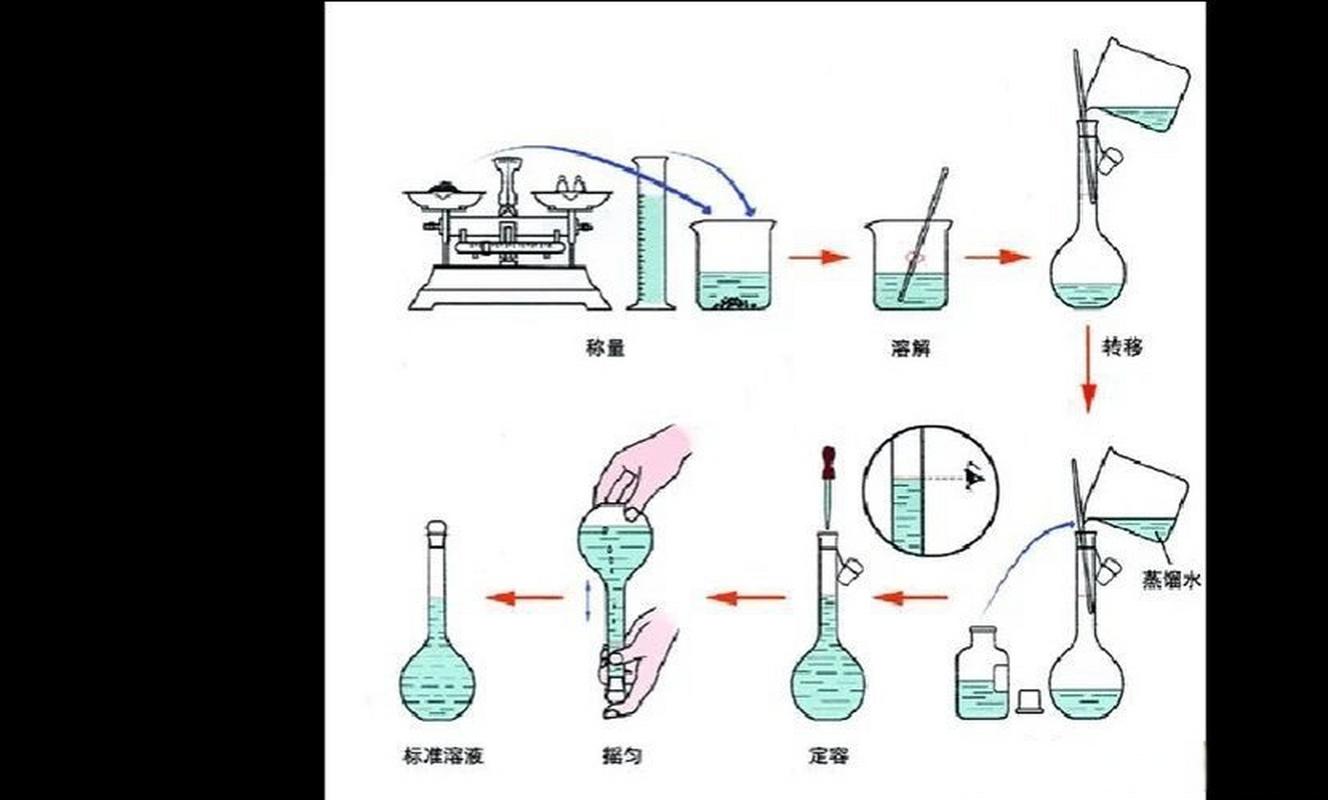
2、例:实验室用密度为18g/mL,质量分数为35%,浓盐酸配制250ml,0.3mol/L的盐酸溶液。v=m/p=(0.25*0.3*35)/(35%*18)称量或量取:固体试剂用分析天平或电子天平(为了与容量瓶的精度相匹配)称量,液体试剂用量筒。
3、要配置20 mM/L的Tris-HCl缓冲液,可以按照以下步骤进行:准备所需的Tris碱和浓盐酸,并确保它们的质量和浓度准确。根据所需的缓冲液体积,计算所需的Tris碱和浓盐酸的量。一般来说,缓冲液的pH值和所需的缓冲液体积是已知的,可以根据这些信息计算出所需的Tris碱和浓盐酸的量。
4、g无水Na2CO3三份,分别倒入3个250mL的锥形瓶中,加入20-30mL蒸馏水溶解后,再加入1-2滴甲基橙指示剂。 用配制的盐酸标准溶液滴定至溶液由黄色变为橙色即达终点,记下滴定时消耗盐酸溶液的毫升数,标定3次,结果与平均值的相对偏差应小于0.3%。完成以上步骤后,即可使用容量瓶配置盐酸溶液。
(图片来源网络,侵删)
5、.02mol/LHCl溶液:量取8毫升盐酸,缓慢注入1000ml水。0.1mol/LHCl溶液:量取9毫升盐酸,缓慢注入1000ml水。0.2mol/LHCl溶液:量取18毫升盐酸,缓慢注入1000ml水。0.5mol/LHCl溶液:量取45毫升盐酸,缓慢注入1000ml水。0mol/LHCl溶液:量取90毫升盐酸,缓慢注入1000ml水。
如何配置20%硫酸溶液。
1、配制20%的硫酸溶液的方法如下:确定所需溶液的总质量:假设我们需要配制100g的20%硫酸溶液。计算所需浓硫酸的质量:浓硫酸的浓度为98%。所需浓硫酸的质量 = 100g × 20% ÷ 98% ≈ 4g。计算所需水的质量:所需水的质量 = 总质量 所需浓硫酸的质量 = 100g 4g = 76g。
2、首先,确定所需溶液的总质量。例如,假设我们需要配制100g的20%硫酸溶液。接着,计算所需浓硫酸的质量。 20%硫酸溶液中的硫酸质量 = 100g × 20% = 20g。 由于浓硫酸的纯度为98%,所以需要浓硫酸的质量 = 20g ÷ 98% ≈ 4g。然后,计算所需水的质量。
(图片来源网络,侵删)
3、在将硫酸加入乙醇后,应继续向混合溶液中加入乙醇,直至总体积达到1000毫升。这个过程需要精确测量,以确保最终溶液的浓度符合要求。在添加乙醇时,也应避免一次性加入过多,以免造成溶液过稀或过浓。完成上述步骤后,需要将配置好的20%硫酸乙醇溶液转移到干净的容器中,密封保存。
4、为了配制100ml的20%硫酸溶液,我们首先需要确定所需98%硫酸的体积。根据稀释公式,V1*P1=V2*P2,其中V1是初始溶液体积,P1是初始溶液的浓度,V2是最终溶液体积,P2是最终溶液的浓度。将已知数值代入公式:V2=V1*P1/P2=100*20%/98%≈4ml。因此,需要4ml的98%硫酸。
配制20%的氢氧化钠1000ml其浓度为?
1、配制20%的氢氧化钠溶液1000ml,其浓度为20%。计算过程为:200g氢氧化钠/40g/mol = 5mol。因此,摩尔浓度即为5mol/L。在配置这种溶液时,需要注意氢氧化钠的强碱性及腐蚀性。通常,步骤如下:首先,准备好所需的设备,如烧杯、玻璃棒和电子天平等。接下来,称取200g的氢氧化钠固体,确保精确称量。
2、氢氧化钠的溶解度在不同温度下有所变化,20摄氏度时,它的溶解度为109克,意味着100克水中可以溶解109克的氢氧化钠。这种饱和溶液的质量分数大约为52%。查阅资料得知,此时饱和溶液的密度约为56克/立方厘米。
3、首先计算出溶质和溶剂的质量,称量氢氧化钠质量为20g,那么溶剂水的质量为80g;最后将二者放入烧杯,用玻璃棒搅拌均匀,冷却,静置,贴上标签。
4、.00g→1000ml 000g→1000ml 【配制】取氢氧化钠液适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。氢氧化钠滴定液(1mol/L) 取澄清的氢氧化钠饱和溶液56ml,加新沸过的冷水使成1000ml,摇匀。
5、%的氢氧化钠【20℃时20%氢氧化钠溶液的密度: 22g/ml 】那么一升氢氧化钠溶液浓度=1220g*20%÷40g/mol=1mol/L PH=14-(-lgc(OH-)=14+lgc(OH-)=1785329835011 所以PH是18左右。加热到60摄氏度,离子积变大,氢离子浓度会变高,就不能再加14了,小于14,PH会减小。
6、查表得室温时,20%氢氧化钠的密度ρ=220 g/ml。
浓盐酸(38%)配成100ML20%盐酸怎么配置
需要注意的是,这里假设了两种盐酸溶液的密度D1和D2是已知的。如果知道具体的密度值,就可以计算出需要多少毫升的36%盐酸来配制100ml的20%盐酸溶液。配制过程还需要注意以下几点: 在配制过程中,要确保所用的容器干净,避免引入杂质。 配制时应小心操作,防止盐酸溅出,造成伤害。
现有30%的盐酸和10%的盐酸,配制15%盐酸溶液:20%与10%盐酸的质量比,则(15-10)/(30-15)=5/15=1/3。
× V1 = 0.2 × 0.5 解出V1,得到:V1 = (0.2 × 0.5) ÷ 0 = 0.1升 = 100毫升 因此,您需要从100毫升的0M盐酸中取出100毫升,加入水中,使最终体积为500毫升,即可制得20%的盐酸溶液。需要注意的是,盐酸是一种强酸,具有强烈的腐蚀性。
你的题目有问题,弄硫酸才能达到98%的浓度。 用浓度为x%的浓盐酸要得到20%浓度的盐酸,可以用下面的公式,要得到Lml的目标盐酸,需要纯盐酸的量L*0.2,需要浓盐酸的量为L*0.2/x%,那么加水的量为L-L*0.2/x%。厉害哦~~~抱歉我的题目有问题。
要配置200mL浓度为20%的盐酸溶液,可以使用37%浓度的盐酸。首先,计算所需37%盐酸的体积。根据公式20%×200=37%×y,解得y=108mL。这意味着需要108mL的37%盐酸。剩下的体积92mL需要用水补充,因此取108mL的37%盐酸,再加92mL的水即可。另一种方法是考虑通过移液来实现精确配置。
1000毫升20%的盐酸溶液的配置方法
1、例:实验室用密度为18g/mL,质量分数为35%,浓盐酸配制250ml,0.3mol/L的盐酸溶液。v=m/p=(0.25*0.3*35)/(35%*18)称量或量取:固体试剂用分析天平或电子天平(为了与容量瓶的精度相匹配)称量,液体试剂用量筒。溶解:将称好的固体放入烧杯,用适量(20~30mL)蒸馏水溶解。
2、盐酸标准溶液的配制方法如下:0.1mol/L的HCl溶液,量取9毫升的盐酸,缓缓注入1000毫升的水中;0.2mol/L的HCl溶液,量取18毫升的盐酸,缓缓注入1000毫升的水中;0.5mol/L的HCl溶液,量取45毫升的盐酸,缓缓注入1000毫升的水中;0mol/L的HCl溶液,量取90毫升的盐酸,缓缓注入1000毫升的水中。
3、配制稀盐酸溶液,是用浓盐酸(c=12mol/L)进行浓盐酸稀释的方法配制:向确定要配制的稀盐酸的浓度C 和体积V;计算:需要移取的浓盐酸的体积v,v = CV/c 配制:用移液管移取v毫升的浓盐酸,加入V体积的 容量瓶中,加蒸馏水定容,即可。
4、配制:0.02mol/LHCl溶液:量取8毫升盐酸,缓慢注入1000ml水。0.1mol/LHCl溶液:量取9毫升盐酸,缓慢注入1000ml水。0.2mol/LHCl溶液:量取18毫升盐酸,缓慢注入1000ml水。0.5mol/LHCl溶液:量取45毫升盐酸,缓慢注入1000ml水。0mol/LHCl溶液:量取90毫升盐酸,缓慢注入1000ml水。
5、要配制0.2mol/l的盐酸溶液1000ml,有两种方法可供选择:首先,采用精确计量法: 用量筒量取18毫升浓度未知的盐酸,将其转移到1000毫升容量瓶中,然后加水至刻度线。 通过标定法来确定浓度,称取适量无水碳酸钠,进行滴定操作,计算出盐酸的准确浓度。
6、moll盐酸溶液的配制方法如下:确定所需浓盐酸的体积:根据溶液稀释公式c1v1=c2v2,假设要配制的溶液体积为1000毫升,且浓盐酸的浓度假设为12moll,则所需浓盐酸的体积v1=c2v2/c1=2×1000/12≈1667毫升。取浓盐酸并加水稀释:使用量筒准确量取1667毫升的浓盐酸。
20%的盐酸要怎么配制呢?
/(100+x) ×100%=20 通过解这个方程,可以得到x的值为85毫升。这意味着,为了从100毫升37%的盐酸中制备出20%的盐酸溶液,我们只需要向其中加入85毫升的水即可。需要注意的是,这种计算方法基于一定的假设,实际操作时还需考虑温度、压力等因素对溶液密度的影响。
假设要配制20%的盐酸共100g ,只需称取54g 37%的盐酸,再加入45g 水,混匀即可。
市售浓盐酸的浓度为24%,实验用浓盐酸一般为35%-37%,密度179g/cm3,是一种共沸混合物。你的题目有问题,弄硫酸才能达到98%的浓度。
%的AR浓盐酸的密度为19(g/ml),水的密度为1(g/ml)。20g/0.37/19g/ml=442(ml)盐酸 精确量取442(ml)37%的AR浓盐酸(含盐酸溶质20g),精确量取80ml蒸馏水(密度为1g/ml,质量为80g),混合搅拌均匀即得到质量分数为20%的盐酸溶液100g。
在实验室环境中,配制20%的盐酸溶液100升,需要计算浓盐酸的具体用量。已知市面上常用的浓盐酸浓度大约为35%。假设需要x升的浓盐酸,可以按照以下公式进行计算:(35% * x / 100) = 20%。通过简单代数运算,可以得出x = 5333升。
关于20%浓度怎么配置和20%的浓度怎么配的介绍到此就结束了,不知道你从中找到你需要的信息了吗 ?如果你还想了解更多这方面的信息,记得收藏关注本站。
本文可能通过AI自动登载或用户投稿,文章仅代表原作者个人观点。本站旨在传播优质文章,无商业用途。如侵犯您的合法权益请联系删除。